Petições que já tenham sido alvo de avaliação por autoridades passam a tramitar com mais agilidade perante a Anvisa, facilitando a regularização desses produtos
A Anvisa (Agência Nacional de Vigilância Sanitária) publicou, em 25 de março, a Instrução Normativa IN n° 289/2024, que regulamenta a RDC nº 741/2022 e estabelece critérios para a avaliação otimizada de petições de registro e pós-registro de medicamentos, produtos biológicos, vacinas e de carta de adequação de dossiê de insumo farmacêutico ativo (CADIFA), em que sejam utilizadas avaliações aprovadas por Autoridades Regulatórias Estrangeiras Equivalentes (AREE).
O processo de avaliação otimizada aproveita-se de análises prévias já realizadas por autoridades regulatórias estrangeiras, reconhecidas pela Anvisa como equivalentes, para trazer mais eficiência ao procedimento de análise petições de registro e pós-registro pela própria Anvisa.
Assim, petições de registro e pós-registro que já tenham sido alvo de avaliação por essas autoridades passam a tramitar com mais agilidade perante a Anvisa, facilitando a regularização desses produtos.
Os efeitos da Instrução Normativa passaram a valer no dia 1º de abril. Confira abaixo as entidades regulatórias estrangeiras consideradas como equivalentes (AREE) pela Anvisa, de acordo com o Anexo I da IN:
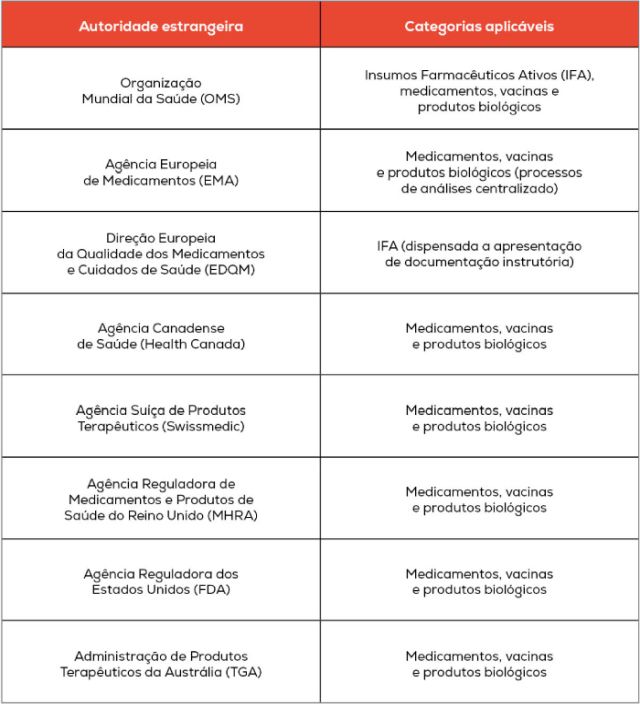
O processo de avaliação otimizada é genericamente regulado pela RDC nº 741/2022. No entanto, com relação a algumas categorias de produtos, como medicamentos, produtos biológicos e suas substâncias ativas, a regulação aplicável era a RDC nº 750/2022, que havia sido publicada em caráter temporário e cuja vigência expirou em 31 de março de 2024.
Relevante mudança – Extensão do benefício às vacinas
Uma inovação relevante trazida pela IN n° 289/2024 é a extensão do procedimento de regularização otimizado às vacinas, o que antes era vedado pela RDC nº 750/2022.
Regras Gerais
De acordo com a IN, para a aplicação do procedimento de avaliação otimizado, deverá ser demonstrado pela empresa interessada que o produto alvo de petição de registro ou pós-registro possui características essenciais idênticas às aprovadas pela AREE, inclusive quanto aos seus aspectos de qualidade.
Havendo quaisquer diferenças entre o produto submetido à Anvisa para regularização e o produto aprovado pela AREE, o fabricante ou empresa peticionante deverá apresentar as devidas justificativas, sob pena de ser negada a solicitação de registro ou pós registro pela via otimizada, e sujeitando-se, portanto, à via ordinária de análise.
Os requisitos para a elegibilidade do pedido de regularização pela via otimizada são descritos nos Anexos II e III da IN n° 289/2024.
A critério da Anvisa e da documentação disponibilizada, poderá ser concedido o procedimento otimizado de forma completa ou parcial. Será concedido de forma integral caso a Anvisa verifique que foram disponibilizados registros suficientes acerca dos requisitos de qualidade, segurança e eficácia do medicamento, insumo farmacêutico ativo (IFA), vacina ou produto biológico.
A concessão parcial será aplicada caso a documentação instrutória submetida for suficiente para avaliação de uma ou mais partes do dossiê de regularização, mas não for suficiente para análise completa do pedido de regularização.
É importante registrar também que toda a documentação relacionada à aprovação da AREE deve ser disponibilizada à Anvisa de forma completa e sem que haja a omissão de nenhuma informação. Também devem ser disponibilizadas eventuais petições de pós-registro que estejam relacionadas à aprovação da AREE. Além disso, eventuais decisões regulatórias restritivas adotadas pela AREE deverão ser imediatamente reportadas à Anvisa pela empresa requerente.
Reenquadramento de petições sob o rito ordinário com avaliações concluídas por AREEs ao rito otimizado
Por fim, para as empresas do ramo cujos produtos estejam sob a via ordinária de regularização e que possuam avaliações concluídas por AREEs, a IN n° 289/2024 possibilita que seu processo de regularização seja reenquadrado no procedimento otimizado, caso seja demonstrado o cumprimento das exigências da norma.
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.

